暑い日が続くのはしんどいですが、花粉症の季節が終わってマスクを付けなくていいのはありがたいですね。
喘息やアレルギー性鼻炎の原因となるアレルゲンは、花粉、ダニ、カビなど多種多様です。このようなアレルゲンに対するTh2や好酸球による2型免疫応答の活性化が、アレルギー症状の原因ということが知られています。
しかし、1型免疫応答や3型免疫応答がいわゆるPattern recognition receoptorによって共通の構造を認識するシステムによって活性化するのに対し、2型免疫応答が多種多様なアレルゲンに対してどのように活性化するのかは分かってないことが多いです。
先日Nature に掲載された論文は、カビの毒素やアスペルギルスの抗原が気道上皮細胞膜に“穴”を開けることがアレルギー反応を引き起こす共通の引き金になることを示しました。
Nature: Epithelial cell membrane perforation induces allergic airway inflammation

IL-33:アレルギー開始の重要なサイトカイン
IL-33はIL-1ファミリーに属するサイトカインで、上皮細胞の核に常在し、細胞損傷時に“アラーミン”として放出されます。
放出されたIL-33は、ILC2(2型自然リンパ球)やTh2細胞に作用し、IL-5やIL-13といったサイトカインの産生を促進することで喘息やアトピーなど典型的な2型アレルギー炎症を引き起こします。
しかしIL-33は通常、核内にとどまっており、一般的なサイトカインのようにERやゴルジ体を経由した分泌経路を使いません。アレルゲンがどうやってIL-33の放出を促すのか、その仕組みは長く謎でした。
※IL-33は切断部位によって活性化・不活化が変わるユニークな性質もあり、興味のある方はこちらも参考になります →
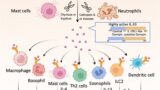
Alternaria alternata と2つのカビタンパク質
研究チームは、喘息のモデル実験でよく用いられるカビ Alternaria alternata(ススカビ) に注目しました。
Figure 1 では Alternaria alternata 抽出物からアレルギー反応を誘導するタンパク質を精製するため、6段階の分画が行われています。各ステップで、IL33の放出・下流シグナルのMAPK活性化(MEK/ERKリン酸化)・炎症性遺伝子発現(AREGなど)を指標に活性を追跡しました。
ここがとても面白いところなのですが、分画した精製物を細胞にかけてもどの分画もIL-33の放出を誘導しませんでした。そこで彼らは低分子のComponent Aと高分子のComponent Bを混ぜて細胞にかけてみることでMAPKが活性化することに気づいたようです(Figure 1C-E)。
ここから生化学的な精製を繰り返して、Aeg-S(aegerolysinファミリー)と Aeg-L(MACPFドメインタンパク質)の2種類が、アレルギー反応を起こす中心成分であることが判明しました
2つのタンパクにより穴が開くメカニズムの解明
次に研究チームはこれらのタンパク質でなぜIL-33の放出が起きるのかを調べました。前述したようにIL-33はゴルジ体の輸送経路にのらないため、別のメカニズムで細胞から外に出る必要があります。
彼らは電子顕微鏡で細胞を調べて、これらのタンパク質が両方存在すると細胞膜に穴が開くことを見つけました。
彼らはこの穴がIL-33の放出に重要であると考えて、クライオ電子顕微鏡(Cryo-EM)を使って構造解析を行い、これらのタンパク質が 18量体のポア構造 をとることを明らかにしました(Figure.2)。
Aeg-S がスフィンゴミエリンやコレステロールを多く含む膜に結合し、Aeg-Lが結合する土台になります。次にAeg-LはAge-Sに結合して構造変換を起こし、βヘアピン構造が脂質二重膜に突き刺さり、リング状の大きな孔を作ります。
ポアが開くと何が起きる?
この孔が開くと、
- IL-33 などの “アラーミン” が放出される
- 細胞外の Ca²⁺ が急激に流入
- MAPKシグナルが活性化し、炎症性遺伝子が誘導
といった一連の反応が起き、最終的に タイプ2免疫(Th2細胞、好酸球、IgE)が活性化します。
KO実験で必須性を証明
さらに、研究チームは Aeg-SまたはAeg-Lを欠損させた Alternaria 変異株 を作製。
これらをマウスにすると、野生株が誘導するような IL-33放出、MAPK活性化、好酸球浸潤、IgE上昇 が、KO株ではまったく起こりませんでした。
リコンビナントタンパク質を補うと、再び反応が起こることから
Aeg-S/L がカビのアレルゲン性に不可欠 であることが明確に示されました。
他のポア形成毒素でも同じ現象が
興味深いのは、この現象がAlternaria特有ではなかった点です。
研究者たちは、Aspergillus(アスペルギルス)やミミズの毒素 Lysenin、イソギンチャク毒 Equinatoxin II など、他の ポアを形成する毒素(PFTs) をマウスの鼻に投与しました(Figure.5)。
どれも 好酸球浸潤とIgE上昇を伴うタイプ2免疫応答 を引き起こしたことから、
「膜に穴が開く」こと自体がアレルギーの共通トリガー である可能性が浮かび上がりました。
研究の意義と今後の展
この研究は、アレルゲンの多様性を超えて共通する免疫トリガー(=膜の穿孔) を初めて明確に示しました。
今後は、
- 膜穿孔によるCa²⁺シグナルやMAPK経路を狙った治療法
- ポア形成毒素の無毒化・阻害剤
といった新しいアレルギー治療の可能性が開かれます。
✅ まとめ
- Alternaria alternata の Aeg-S/Aeg-L が上皮細胞膜に穴を開け、IL-33放出&タイプ2免疫を誘導
- Aeg-SまたはAeg-Lを欠損させたカビはアレルギー反応を起こさない
- 他のポア形成毒素でも同じ現象が確認され、「膜穿孔=共通の危険信号」 という新しい概念が生まれました
感想
インフラマソームなど内在性タンパク質が形成するポアの重要性はよく知られていますが、外部由来のポア形成がアレルギーを活性化するという視点は新鮮でした。
気になった点としては、IL‑33が本当にこのポアを通って出ているのかは明示されていないこと、また 核内にあるIL‑33がCa²⁺流入をきっかけにどのように細胞質に移行するのか がまだ不明な点です。
これらの謎が今後明らかになっていくのが楽しみです。

コメント